 打印本文
打印本文  关闭窗口
关闭窗口
基因编辑:治疗新策略
适合“干细胞移植疗法”的细胞要从哪里来呢?即使CCR5-Δ32突变率较高的高加索人种中,其纯合概率也仅有1%,十分稀有。因此研究人员想到,能不能人工“创造”出这样的“突变”,然后移植给患者呢?
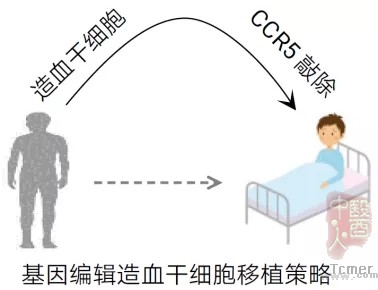
当然可以!这也正是邓宏魁教授课题组采取的方案。在成体造血干细胞上敲除CCR5基因,结合已经在临床上成熟应用的造血干细胞移植技术将编辑后的细胞移植给患者。造血干细胞在患者体内增殖、分化,最终可以形成能够抵御HIV病毒感染的免疫细胞。更重要的是,该策略编辑成体细胞,不会遗传给后代,不存在伦理问题,是理想的治疗策略!
CRISPR:基因编辑的“剪刀”
CRISPR是原核生物(比如细菌)基因组内的一段重复序列,该类基因组中含有曾经攻击过该细菌的病毒的基因片段。它是怎么成为“剪刀”的呢?这还要从它的作用说起。
病毒在攻击目标细胞时,会把自身DNA整合到宿主细胞中。面对此等“不速之客”,细菌会利用各种方法“清理门户”,CRISPR/Cas9系统就是其中的一种。这是一种存在于细菌当中的后天免疫机制,它能识认出外来DNA并加以记录。以后,如果有相同的病毒再次“来犯”,这种机制就能立刻将其识别,并摧毁其DNA,防止自身沦为“病毒工厂”。
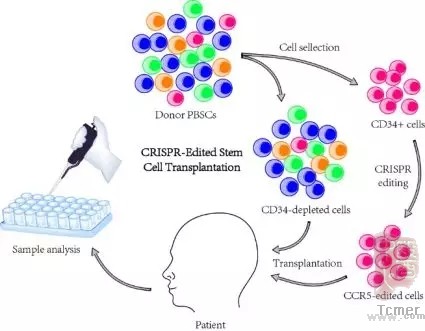
自然环境中的CRISPR机制可以清除外来的DNA片段,是细菌保护自身的“利剑”;而在研究人员手中,它就成为了基因编辑的“剪刀”。2017年,邓宏魁课题组建立了利用CRISPR/Cas9进行人造血干细胞基因编辑的技术体系。利用这种比传统的基因编辑组技术更易用、成本更低的技术,他们完成了人成体造血干细胞上CCR5基因的敲除。
除了精准的“剪刀”之外,课题组还有“额外技能包”:通过缩短Cas9在细胞内的持续时间、引入配对gRNA等策略,他们实现了极低的脱靶效率,做到了高效的基因编辑;而通过非病毒转染的方式将Cas9-gRNA核糖核蛋白复合体递送进细胞,还规避了外源DNA的引入,使得治疗结果更加放心可靠。
临床治疗的曙光
2017年,邓宏魁课题组优化此技术体系,致力于该技术的临床应用。通过原解放军第307医院伦理委员会审批后,该研究组在ClinicalTrials.gov网站上进行了临床研究注册(NCT03164135)。
2017至2019年9月,研究组展开临床实验,采集白血病合并艾滋病患者动员后的外周血,从中获得CD34阳性的造血干细胞并对其进行基因编辑,然后与阴性细胞共同回输到患者体内。移植前结果表明:CD34+细胞上的CCR5基因敲除效率达到了17.8%。移植后,患者的白血病得到缓解!
随后为期19个月的临床观察发现:对该患者短暂停止服用抗HIV病毒药物,CD4细胞中的CCR5基因编辑效率有明显上升,证明了CCR5基因编辑的T细胞表现出一定程度抵御HIV感染的能力。重要的是,基因编辑效果在血液细胞中始终稳定存在,未发现基因编辑造成的脱靶及其他副作用!
这项长达多年的工作已经初步证明了基因编辑造血干细胞在临床应用中的可行性与安全性,势必将促进和推动该技术的临床应用。
除了艾滋病和白血病,其他血液系统相关疾病,如β地中海贫血等,均有希望利用以CRISPR为代表的基因编辑技术看到临床治疗的曙光!
关于该项研究的未来,邓宏魁教授表示,要通过各种方法优化基因编辑造血干细胞移植方案,以降低脱靶率,实现100%的敲除效率。
期待邓宏魁课题组进一步的研究成果,更期待中国科学家们越来越多的国际声音!
 打印本文
打印本文  关闭窗口
关闭窗口