 打印本文
打印本文  关闭窗口
关闭窗口 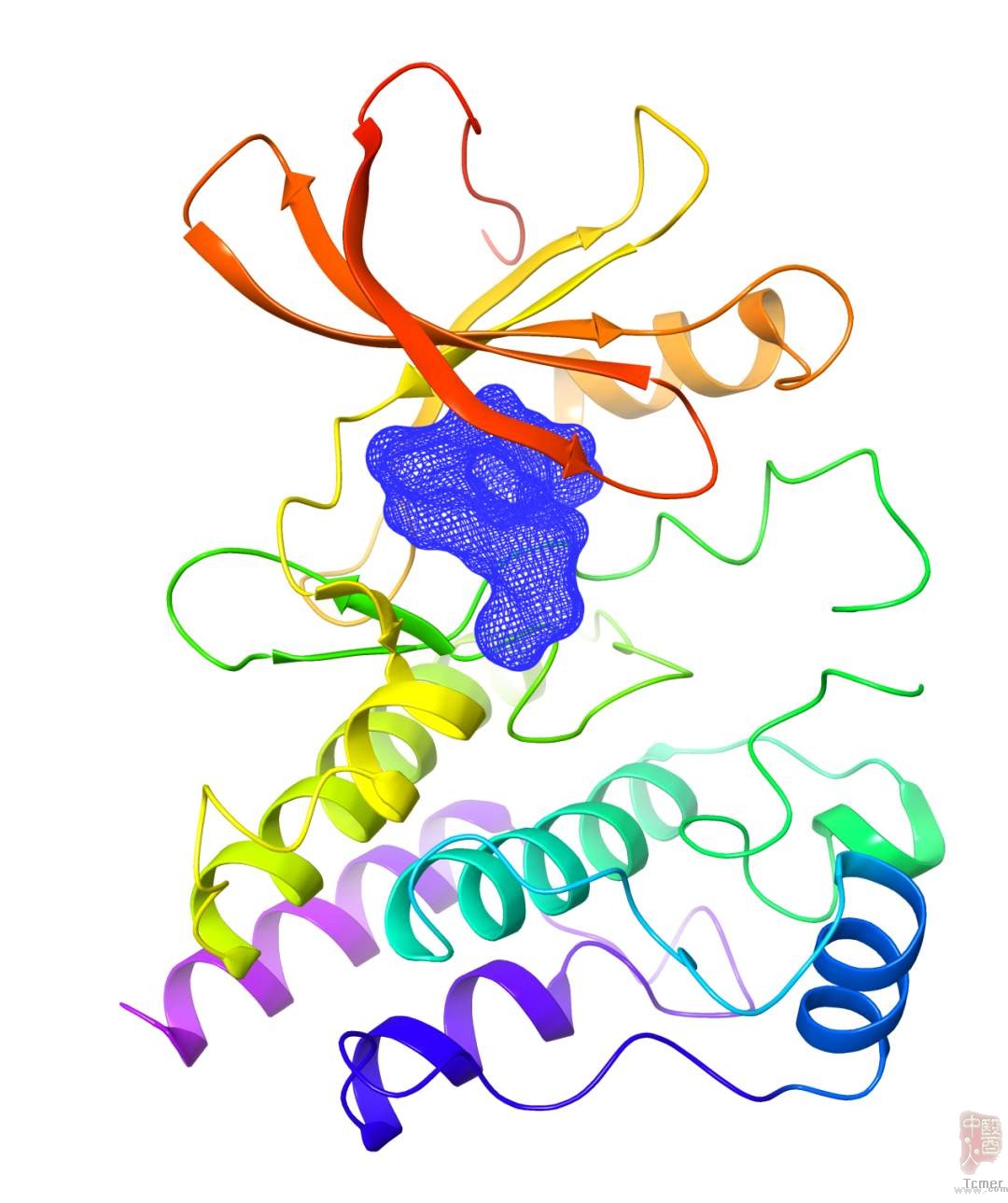
泽布替尼与BTK蛋白复合物晶体结构示意图。
由此,泽布替尼成为第一个在美获批上市的中国本土自主研发抗癌新药,改写了中国抗癌药“只进不出”的尴尬历史。
今日百济神州(BeiGene)宣布,美国FDA已经接受该公司为BTK抑制剂泽布替尼(zanubrutinib)递交的新药申请,用于治疗复发/难治性套细胞淋巴瘤(R/R MCL)患者。Zanubrutinib (BGB-3111)属于BTK抑制剂,相比全球第一个上市的重磅BTK抑制剂伊布替尼而言,有更好的安全性、耐受性、生物利用度,更持久的疾病源抑制能力,有望成为best in class。2016年的6月23日,6月29日,7月20日,Zanubrutinib陆续获得FDA的3项孤儿药资格认定,分别用于治疗套细胞淋巴瘤、华氏巨球蛋白血症和慢性淋巴细胞白血病。以上三种疾病都属于与B细胞有关的恶性疾病。BGB-3111一举获得3项孤儿药资格认定对于其加快全球上市速度和公司成长具有重要意义。值得注意的是,泽布替尼在今年早些时候获得FDA授予的突破性疗法认定,这是首款获得FDA突破性疗法认定的中国本土公司研发的抗癌疗法。
百济神州是2010年10月28日由王晓东和欧雷强在北京成立,2011年建立研发中心。2013年与勃林格殷格翰合作生产,2016年与康泰伦特合作生产。同年在纳斯达克交易所挂牌上市,首次公开募股1.82亿美元。2017年7月与赛尔基因达成战略合作。2018年8月8日在香港交易所挂牌上市。这是中国本土第一家专注于创新药研发领域的企业,可以说代表着中国新药研发的最高水平,而Zanubrutinib则是这家公司向市场交出的第一份答卷,从目前的成绩来看,这份答卷还是合格的。那么我们来看看这份答卷究竟是如何完成的?
BTK基因1993年被科学家发现,后续研究证明了它是个对B细胞发挥功能非常重要的蛋白。大家可以把它理解为B细胞生长的核心开关,很多B细胞功能相关的重要分子信号都汇集到BTK蛋白上。它控制着细胞的扩增、分化,凋亡以及迁移。当BTK基因由于突变而失活时,骨髓里的B细胞就无法发育成熟。当BTK过度活跃时,同样会带来病变。体外与临床实验均表明,BTK与B细胞恶性肿瘤(如弥漫性大B细胞淋巴瘤、慢性淋巴细胞白血病等)和自身免疫病(如类风湿性关节炎与红斑狼疮)相关。因此针对BTK这个靶点的药物,将会是相关疾病的一个重要的治疗方案。BTK的酪氨酸残基与ATP结合之后,才能实现磷酸化,BTK抑制剂竞争性地与ATP 活性位点结合,达到阻断B细胞信号通路的作用。但大部分BTK抑制剂不具有选择性,安全性不佳。如何寻找高效安全的BTK抑制剂是该类抑制剂研发的难点所在。
第一个上市的BTK抑制剂是伊布替尼(ibrutinib)。这个分子通过与BTK的共价的不可逆结合,而实现了选择性和活性的平衡。它最初来自知名科学家Craig Venter博士创立的Celera Genomics,之后Pharmacyclics的CEO Richard Miller博士发现了这个新药项目,并将该项目下的化合物悉数买下,进行抗肿瘤新药的开发。2011年,强生(Johnson & Johnson)公司与Pharmacyclics达成协议,强生公司支持Pharmacyclics新药伊布替尼的研发工作,并付出 1.5 亿美元的首付款.2015年,艾伯维(AbbVie)以210亿美元收购Pharmacyclics,与强生公司一道,继续伊布替尼的研究工作。2013年,伊布替尼获美国FDA批准上市,成为唯一一个获得FDA三项突破性治疗指定的药品,用于治疗套细胞淋巴瘤、华氏巨球蛋白血症和染色体17p缺失的慢性淋巴细胞白血病。自2013年首次获批以来,Imbruvica也已经获得了10个批准,治疗套细胞淋巴瘤、慢性骨髓性白血病、以及华氏巨球蛋白血症等疾病。另外,伊布替尼还处于针对其他适应症的临床研究,包括弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、非霍奇金淋巴瘤、胰腺癌,急性淋巴细胞白血病、急性骨髓性白血病、中枢神经系统肿瘤、多发性骨髓瘤、胃肠癌、非小细胞肺癌、肾细胞癌等等。伊布替尼自2013年获批上市以来,全球销售额持续增长。从2014年的6.92亿美元,增长至2018年的62.05亿美元,位列2018年全球药品销售榜单第11位。
2017年,第二个BTK抑制剂药物,阿斯利康的新型靶向药物Acalabrutinib治疗套细胞淋巴瘤)被FDA批准上市。Acalabrutinib的基本骨架结构以及适应症都和伊布替尼非常类似, 可以看作一种伊布替尼的me-too药物。
除了这两个上市药物之外,目前国内外仍然有多款BTK抑制剂在研,其中最接近上市的就是本次获得美国FDA突破性疗法认定的zanubrutinib。
百济神州的BTK抑制剂研发项目于2012年7月正式立项,而此时伊布替尼的二期临床已经完成,结果也非常理想,强生也于一年前(2011年)参与到该项目中。由于泽布替尼的结构于伊布替尼非常相似,很显然百济神州借鉴了伊布替尼的研究工作,并以其骨架结构为先导化合物就行结构优化。2014年5月,百济神州首先在澳大利亚递交了临床试验的申请。当年7月,第一批临床批次的BGB-3111胶囊生产问世,而患者的招募工作也恰好在同一时段完成。2014年8月,BGB-3111在澳大利亚完成了首名患者的给药。此时,距离百济神州对BTK抑制剂的立项,仅过去了2年零1个月。这一效率在医药研发领域可以说是相当高的。2016年,百济神州得到WHO确认,将BGB-3111正式命名为“zanubrutinib”。由于泽布替尼和伊布替尼以及Acalabrutinib的结构和作用机制都是相似的,所以适用症范围也是相同的。2016年7月,zanubrutinib在中国进入临床,2017年1月,全球3期注册性临床试验启动。如今,它在全球的临床试验中,已经治疗超过了1300名患者,治疗的疾病范围包括华氏巨球蛋白血症(Waldenstrm macroglobulinemia,3期临床试验)、初治的慢性淋巴性白血病/小淋巴细胞淋巴瘤(CLL/SLL,3期临床试验)、复发/难治性滤泡性淋巴瘤(2期临床试验)、以及套细胞淋巴瘤(2期临床试验)。目前FDA授予这一新药申请优先审评资格,预计将在明年2月底之前作出回复。根据其临床实验结果,该药获得FDA也仅仅是时间问题,这将是中国新药研发的一个重大突破。
在中国,zanubrutinib已经于2018年8月和10月,其治疗套细胞淋巴瘤和慢性淋巴性白血病/小淋巴细胞淋巴瘤的新药上市申请先后获得NMPA受理。如今,这两项适应症的申请都已经被纳入优先审评品种,有望加快在中国上市的步伐。
Zanubrutinib的研发成果,可以算是百济神州对市场交出的一份合格的答卷,但是距离满意还是有些差强人意。从其上市时间来看,距离第一个BTK抑制剂上市已经过去了6年,距离第二个BTK的上市时间已经有两年,所以其市场占有率很难保证。从其结构和作用机制来说,和之前的BTK抑制剂并没有明显的区别,所以很难说是best-in-class,在国外的市场表现如何仍然需要时间来检验。从其原创性来说,这个药物无论是从靶点还是结构上都不是第一个,甚至不是第二个,这个与之前开发的埃克替尼是同一级别的研究工作。其所宣传的突破性疗法认定也并不是其所独有,所以该药最后很可能是一个me-too药物。
不过Zanubrutinib作为本土自主研发的BTK靶向药物,Zanubrutinib上市后肯定会在国内成为伊布替尼的强大竞争对手,并且由于其研发时间比较短,所以将具有较大的成本优势。所以这个药物将会和埃克替尼一样,大大降低此类药物的价格,惠及广大患者。所以我依然衷心祝贺百济神州BTK抑制剂泽布替尼的成功,也祝愿其发展越来越好,引领中国医药研发。
 打印本文
打印本文  关闭窗口
关闭窗口