 打印本文
打印本文  关闭窗口
关闭窗口 日本
注重创新支持力度,高临床价值高溢价鼓励本土开发并首报上市申请
日本医保支付方十分注重对国内创新药产业发展的扶持,对新作用机制、高临床价值、罕见病用药以及优先在本土开发上市的新药等都有很多的扶持措施。其医保准入定价通常分为“有参照品的类似疗效价格比较法”和“无参照品的成本计算法”,而无论哪一种定价方式,真正高临床价值产品都可以获得更高的溢价,因此日本医药产业里,也陆续出现了包括DS-8201在内的现象级重磅新药。
为鼓励创新药优先在日本开发上市,日本对于此类优先在日本上市无外国参照品的创新药采取成本计算法,在考虑研发成本、生产成本、营销费用和营业利润等因素进行定价,而营业利润则可根据创新性、疗效、安全性调整在-50%和+100%之间1,根据此法定价的产品包括了纳武利尤单抗和恩美曲妥珠单抗等产品,此类鼓励手段之优效,以至于使得小野制药在日本纳武利尤单抗的定价超过百时美施贵宝在美国定价的两倍1,2。
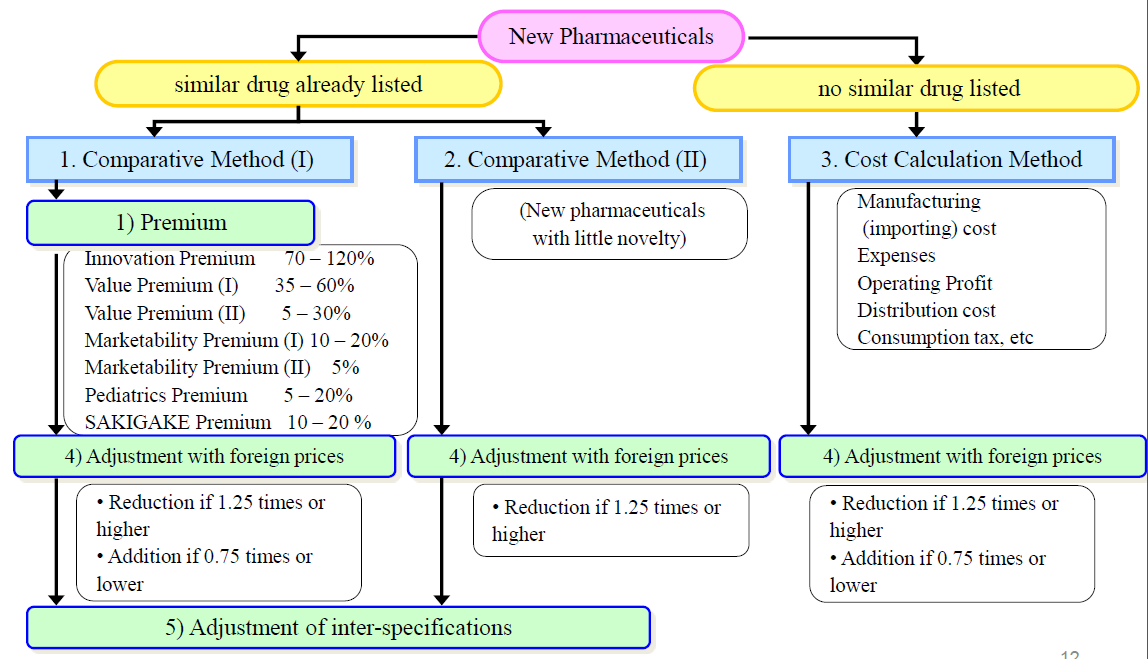
对于存在有参照品的创新药,则通常根据参照品药品花费折算新药定价,而创新带来的溢价更是高达70-120%,这类指标包括了新的作用机制、高疗效和安全性、治疗方案疗效显著提升等等,另外孤儿药、市场较小规模的新药和儿科用药也可以获得相应5%-20%的溢价。

同时日本SAKIGAKE(先驱)认定也被纳入溢价规则之一,该认定与美国的突破性治疗认定(BTD)相似,主要针对临床疗效突出的在研产品,在日本这一项认定还包含了首先在日本开发,且有望首先或者同时在日本提交首个全球上市申请等内容。
台湾
区分真创新和Me-better/too鼓励在岛内开展临床研究
台湾地区对高价值创新药支持力度也有不同的举措,相较Me-better和Me-too类更具临床价值的治疗药物通常采用参照十国(美国、加拿大、日本、英国、德国、法国、瑞典、瑞士、比利时、澳大利亚)药价中位数进行定价,而Me-better或者Me-too仅可以参照十国药价中位数作为上限定价,通常上选择的是十国药价最低价、原产国药价、国际药价比例法等方案。
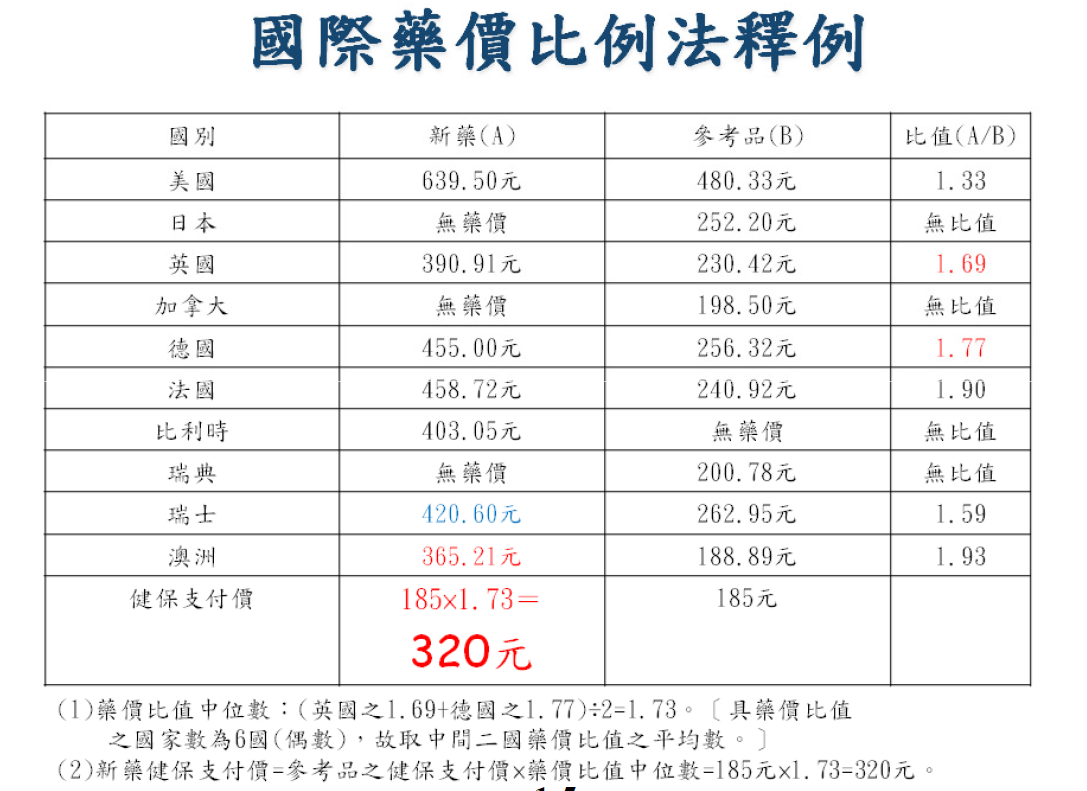
对于本土创新药发展的鼓励政策也是十分明确4,在新药支付价格制定时,明确规定对于致力于台湾人族群特异性疗效及安全性研发,在岛内实施临床试验达一定规模的创新药,可获得10%溢价。这一举措可吸引跨国企业将台湾纳入一定规模的国际多中心临床,在当地设置高水平科研创新人员,带动本土创新药开发人才队伍建设,推动台湾本土创新药研发水平的提升。
韩国
创新药在韩国可获更高定价新增适应症调价相对有限
在韩国新药医保准入价格确定时5,如果存在可替代治疗产品,同时临床研究结果未能表现出足够优效,则参考可替代药品均价的方式进行定价,通常定价在均价的90%-95%左右,儿科用药产品定价则可以达到均价95%,一般品种就只有90%,同时也会倾向于罕见病、全新作用机制等治疗产品,该类别新药通常可以获得与可替代品均价相当的定价。
而高临床价值创新药通常采用传统药物经济学研究结果,对创新药进行成本效果分析(CEA)来谈判获得更高的定价,对于罕见病和肿瘤等治疗新药则可豁免CEA,采用可比价格法,参照欧美日价格进行定价。
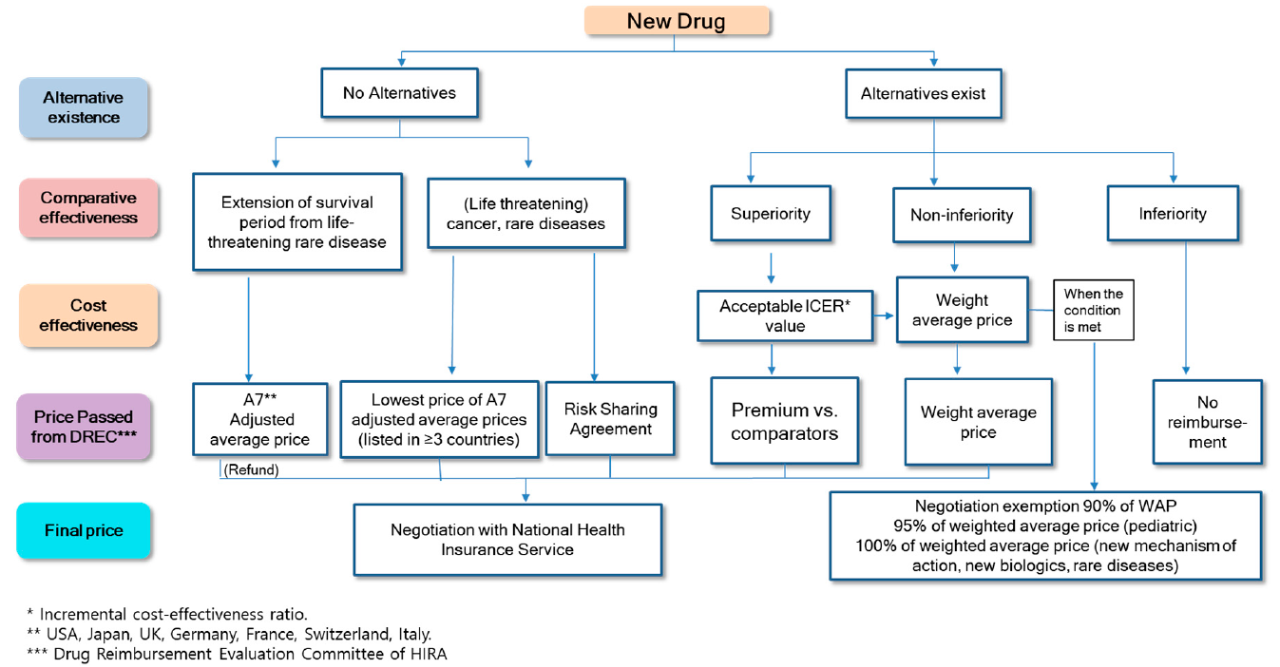
而在医保准入之后,价量协议又可以依据此前约定用量的超出比例进行价格调整,新增获批适应症也会进一步带来控价措施,若因此带来预算支出在15-100亿韩元范围内,降幅通常在1%-5%之内,但孤儿药是不受该政策影响的6。
中国医保改革任重而道远,中国本土创新的发展也已经是常态化,未来如何更好的扶持“中国心、全球新”的药品,或许我们能在国外经验的基础上,完善出符合国情的医保支付政策。
 打印本文
打印本文  关闭窗口
关闭窗口