 打印本文
打印本文  关闭窗口
关闭窗口 
通过调节神经系统抑制肿瘤生长
神经支配在很多不同肿瘤的生长中具有重要作用,包括胶质瘤、前列腺癌、胰腺癌和胃癌等等。常见的信号通路包括神经化学递质(谷氨酸、去甲肾上腺素、乙酰胆碱)以及生长因子(NGF、BDNF、GDNF)。此外,神经元还可以和肿瘤细胞形成肿瘤-神经突触(tumour-nerve synapse)。这些信号传导机制通常会激活促进肿瘤生长的典型致癌信号通路。比如,在高级别胶质瘤和视胶质瘤中,肿瘤周围的神经元和少突触胶质前体细胞释放的可溶性神经调节素3(NLGN3),通过与肿瘤表面的受体相结合可以激活PI3K-mTOR信号通路,导致肿瘤增生。
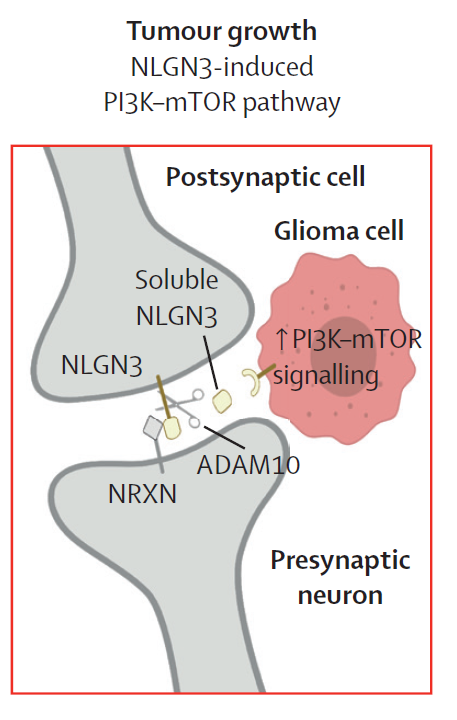
▲神经元释放的NLGN3可以促进肿瘤增生(图片来源:参考资料[1])
这些作用机制意味着,已有的神经调节药物可能作为潜在抗癌疗法。目前的一些回顾性研究和小型前瞻性临床试验已经发现,β-肾上腺素能阻滞剂可能改善肿瘤学后果。“老药新用”是一个吸引人的策略,特别是针对脑瘤,因为很多神经调节药物能够跨越血脑屏障。不过,使用神经调节药物作为抗癌疗法的一个重要临床挑战是这些药物没有肿瘤特异性,在有效剂量水平可能引发其它副作用。目前正在进行的大型前瞻性临床试验可能对神经调节疗法的耐受性和疗效提供洞见。
通过扰乱应激适应机制克服耐药性
侵袭性癌症的一大普遍特征是它们的适应能力,让它们能够在手术、全身性疗法或化疗下的恶劣环境中增殖。近年来的研究发现,神经系统的多个组分起到在应激环境下支持肿瘤生长的作用。比如,胰腺癌细胞在缺乏丝氨酸的时候可以选择性生产NGF,从而吸引神经支配,提供外来的丝氨酸。

▲神经支配可以为缺乏丝氨酸的胰腺癌细胞提供外来丝氨酸(图片来源:参考资料[1])
有趣的是,据估计接近40%的胰腺癌无法自己合成丝氨酸,这意味着这些患者亚群可能从低丝氨酸饮食和高选择性TRK抑制剂larotrectinib构成的组合治疗方案中获益。
重塑免疫肿瘤微环境
免疫检查点抑制剂已经成为多种癌症类型的标准治疗之一。而对神经免疫信号通路的研究发现,神经系统可以通过多种机制,调节组织驻留和淋巴结中免疫细胞的活性。将具有神经活性的药物与免疫检查点抑制剂、细胞毒性疗法、或癌症疫苗联用,可能调节免疫肿瘤微环境,增强抗癌效果。
比如,在黑色素瘤患者中,使用非特异性β-肾上腺素能阻滞剂,在接受免疫治疗的患者中与复发风险降低和总生存期改善相关。早期临床试验发现,将普萘洛尔与Keytruda联用,在局部晚期或转移性黑色素瘤患者中获得78%的初步缓解率。
淋巴结受到丰富的肾上腺素能和感觉神经支配,而β-肾上腺素能受体信号通路调控T细胞迁移离开淋巴结的过程。因此,调节神经信号可能控制T细胞在淋巴结的驻留和释放,对自然和免疫检查点抑制剂激发的免疫反应产生重要影响。
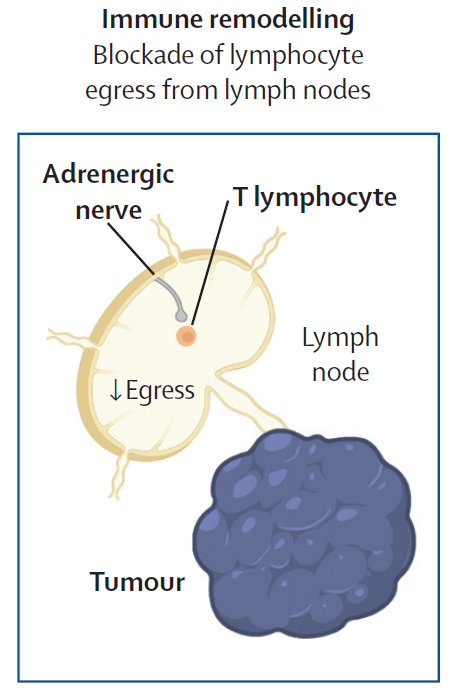
▲β-肾上腺素能受体信号通路调控T细胞迁移离开淋巴结的过程(图片来源:参考资料[1])
很多“冷”肿瘤对免疫检查点反应欠佳的原因之一是肿瘤附近的CD8阳性T细胞稀缺。将免疫检查点抑制剂与放疗和β-肾上腺素能阻滞剂联用的策略值得进一步探索。尤其是针对前列腺癌和胰腺癌,这两种癌症属于神经支配最为密集的癌症类型,并且具有高度神经浸润和交感神经信号。
靶向癌症转移
神经在促进癌症转移方面的作用正在被发现。神经不但可以成为癌症转移的物理通道,还可以介导癌细胞通过血管和淋巴系统的扩散。癌症转移和血管增生以及血管通透性之间的联系已经被确认,VEGF蛋白在其中起到关键性作用。然而,由于血管系统和神经的生长调控经常紧密偶联在一起,NGF、BDNF等神经营养因子被越来越多的科学家认为是异常血管生成的调节因子。在小鼠乳腺癌模型中,抗NGF抗体能够降低肝转移瘤的形成和微血管密度。
此外,神经系统在癌症的脑转移方面也起到重要作用。近期的研究显示,当乳腺癌细胞转移到大脑中后,可以与大脑中的神经突触结合,形成假三元突触( pseudo-tripartite synapse),它可以劫持正常神经突触中释放的谷氨酸,辅助肿瘤生长。
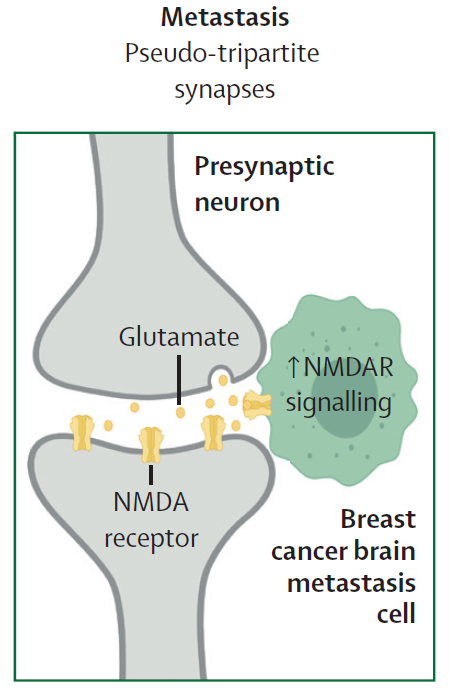
▲乳腺癌细胞可以劫持正常神经突触中释放的谷氨酸,辅助肿瘤生长(图片来源:参考资料[1])
这些研究结果意味着,在癌症早期使用神经活性药物可能阻止或延缓肿瘤转移。在原位可切除乳腺癌患者中进行的2期临床试验结果显示,在手术前接受普萘洛尔治疗降低了与转移潜力相关的生物标志物水平。如果癌症的脑转移已经发生,使用NMDA受体调节剂来靶向转移瘤的生长机制可能是值得探索的途径。
通过扰乱神经电活动控制肿瘤生长和癫痫发作
神经元的电活动对神经发育至关重要,而神经元电活动辅助癌症增生(尤其是脑瘤)的证据也正在涌现。和正常神经系统的发育类似,胶质瘤细胞也受到电活动的影响,并且会向周围环境释放包括谷氨酸在内的生长刺激因子,提高微环境中的神经元活动。由于胶质瘤细胞上存在AMPA受体依赖性突触,胶质瘤和周围的神经元构成一个双向正反馈回路,导致神经和肿瘤的高度活跃和肿瘤的增殖。
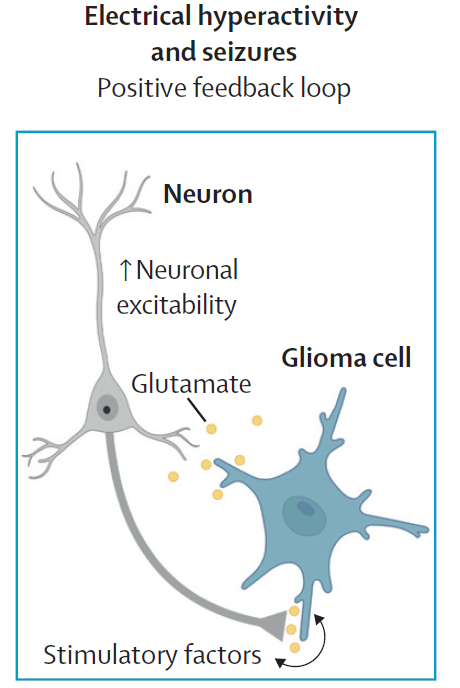
▲释放谷氨酸的神经元和胶质瘤形成正反馈回路(图片来源:参考资料[1])
脑瘤的电活动整合到大脑神经网络中的现象也让科学家们重新审视胶质瘤的临床症状。比如癫痫发作通常被认为是肿瘤和周围的浮肿压迫的副产物。然而它们也可能是由于肿瘤分泌谷氨酸造成神经网络过度活跃而造成的。以往研究也确实发现,产生突触潜力更强的胶质瘤与癫痫频率升高和肿瘤侵袭增强相关。这些发现提出了一个问题,那就是抗癫痫药物是否具有肿瘤学治疗效果?
目前,神经系统的电活性如何影响癌症生长仍然需要更多研究。比如,虽然临床前证据显示谷氨酸具有致癌作用,但是靶向谷氨酸受体的疗法尚未在前瞻性临床试验中展现出积极效果。
通过靶向感觉神经系统控制神经痛
很多癌症患者报告在原位瘤和转移瘤部位出现严重疼痛。这通常与神经浸润相关,神经营养因子和神经调节蛋白的作用是主要原因之一。比如,NGF可以激活背根神经节的感觉纤维,是很多胰腺癌疼痛的重要原因。虽然癌症相关疼痛的治疗通常以控制症状为目的,但是靶向神经痛也可能同时起到控制肿瘤的作用。

▲胰腺癌分泌的NGF导致神经痛(图片来源:参考资料[1])
由于调节神经痛的信号蛋白也具有促进肿瘤生长的效果,这些神经信号通路是吸引人的治疗靶点。比如,靶向NGF的抗体疗法可能在治疗与癌症相关的神经痛的同时,带来抗癌效益。目前,靶向NGF的单克隆抗体tanezumab正在3期临床试验中用于治疗带来疼痛的骨转移瘤。
此外,一款高亲和力辣椒素类似物resiniferatoxin在小鼠中能够杀死感觉神经元的神经纤维。它同时显著阻碍肿瘤进展,目前正在1期临床试验中接受评估,治疗晚期癌症患者的严重或难治性疼痛。
未来的机遇和挑战
综述作者指出,癌症神经科学近年来获得爆发式发展,增强了我们对肿瘤和神经之间交流的机制理解,让分子靶向疗法有望在临床中得到应用。然而,三大主要问题仍未完全获得解答:(1)肿瘤-神经轴能否可以特异性靶向,从而带来广泛临床效益;(2)神经调控能否与已有疗法产生协同作用并整合到已有治疗方案中;(3)组织病理学或其它伴随诊断能否发现最可能从这些治疗策略中获益的患者。
目前,多款靶向肿瘤-神经轴节点的前瞻性临床试验正在进行中,这些临床试验反映了学术界和工业界的联合努力。开发创新疗法之外,将耐受性特征良好的已有神经系统调节药物“老药新用”代表着更多机会。作者表示,肿瘤微环境研究的经验显示,扰乱肿瘤和神经之间的交流最终可能和抗血管生成和免疫调节疗法一样,成为临床肿瘤学的支柱之一。
参考资料:
[1] Shi, et al., (2022). Therapeutic avenues for cancer neuroscience: translational frontiers and clinical opportunities. The Lancet Oncology, https://doi.org/10.1016/S1470-2045(21)00596-9
 打印本文
打印本文  关闭窗口
关闭窗口