 打印本文
打印本文  关闭窗口
关闭窗口 最新款手机、最新的电影大片……在很多领域,国人几乎已经与世界同步了,但在新药引入方面,内地仍旧步履蹒跚。
在美国、欧洲等地获批上市的新药,正式登陆中国内地一般需要再等上三五年,有人将此称为“药滞”现象。
关于进口新药的讨论近来些甚嚣尘上,一些声音在质疑:为何国外新药不能尽快造福国内患者?另一些声音也在质疑:我们真的需要那么急着去做实验用的“小白鼠”吗?
“滞”在哪
为证实进口新药在国内的“药滞”情况,有机构对比了数种针对重病的药物在中美获批上市的时间:适用于多种肿瘤治疗的安维汀(贝伐珠单抗),中国比美国晚72个月;去年初才在国内上市的多发性骨髓瘤治疗药物瑞复美(来那度胺),比美国晚84个月。
为什么国外新药进入国内市场需要这么久的时间?
某制药公司药品注册高级专员林欣(化名)对《中国科学报》记者分析称,原因之一可能是国外新药生产厂家在中国申请注册上市的时间晚于国外。
另外的原因在于新药在国内的注册上市过程也需要一定的时间。因为一种药品要想在我国上市,不管该药是否已获得美国食品药品管理局(FDA)或欧洲药品管理局(EMA)的审批,都需要经过我国国家食品药品监督管理总局(CFDA)的注册审批。
考虑到种族、环境、行为习惯等对药物疗效和安全性的影响,待注册进口药可能需要在中国患者身上再做一定的临床试验,试验量取决于已有的临床数据和参考文献。
然后,CFDA等附属药管部门(如药品审评中心,CDE)还须审批注册申请、审查试验结果,这又需要一定的时间。林欣认为:“中国的药品管理部门还处于成长阶段,工作效率确实有很大的提高空间。”
而同为亚洲黄色人种的日本、中国香港地区,对进口新药的接纳速度比较快,林欣认为:“日本和美国在通贸协定上有很多绿色通道。不同的体制和贸易交流方式导致了审批速度的不同。”
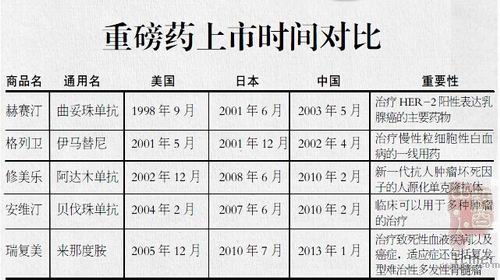
台禹微制图 数据来源:Insight
 打印本文
打印本文  关闭窗口
关闭窗口