 | [中医][图文]清肺排毒汤正式处方来 |
 | [中医][组图]中医抗疫!广州市第八 |
 | [中医][组图]治疗不孕不育、颈椎病 |
 | [中医][图文]中药国际化重大突破: |
 | [中医]国家中医药局:这7个资格证是 |
 | [中医][图文]沉痛悼念国医大师邓铁 |
 | [中医]国务院修改《中药品种保护条 |
 | [中医]南方医科大学中西医结合医院 |
 | [医药][图文]科兴新冠灭活疫苗克 |
 | [医药][组图]南方医科大学有55家 |
 | [医药]专项整治来了!多地基层医 |
 | [社会]最新!多名卫健委官员被双 |
 | [产业]入局者亲述:最激烈的一次 |
 | [维权][图文]演员高溜自曝整容失 |
 | [内科]周仲瑛治疗病毒性脑炎高热 |
 | [中医]四川:砥砺前行 奋力推进 |
 | [维权][组图]广州10余家医院被控 |
 | [医药][组图]新一期ESI公布:中 |
 | [医药][组图]女将挂帅!国务院督 |
 | [医药][组图]世卫组织强调新冠病 |
 | [医药][图文]【光明日报】南方医 |
 | [医药]国家开绿灯 这些医务人员 |
 | [社会][组图]玉林护士杀人碎尸, |
 | [调查]疫情冲击 近6成民营医院面 |
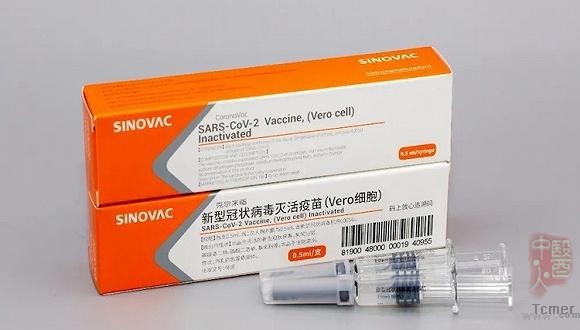
科兴新冠灭活疫苗克尔来福获批附条件上市
|
文章导读:2021年2月6日,科兴控股生物技术有限公司对外宣布,国家药品监督管理局已于2月5日依法批准公司旗下子公司北京科兴中维生物技术有限公司(“科兴中维”)研制的新型冠状病毒灭活疫苗克尔来福在国内附条件上市。 |
克尔来福系用新型冠状病毒(CZ02株)接种非洲绿猴肾细胞(简称Vero细胞),经培养、收获病毒液、灭活病毒、浓缩、纯化和氢氧化铝吸附制成,不含防腐剂。该疫苗适用于18岁及以上人群的预防接种,用于预防新型冠状病毒(SARS-CoV-2)感染所致的疾病(COVID-19)。该疫苗的基础免疫程序为2剂次,间隔14~28天;每一次人用剂量为0.5ml。
2020年6月克尔来福在中国率先获批紧急使用,并自7月开始陆续在国内针对特定人群开展紧急使用。2021年1月以来,印度尼西亚、土耳其、巴西、智利、哥伦比亚、乌拉圭和老挝等国陆续批准克尔来福在当地的紧急使用,目前多个国家针对医务人员、老年人等高危人群已经陆续开展疫苗的接种工作。相关国家均认可科兴中维现有临床研究结果,认为该疫苗对于减少COVID-19导致的就医、住院、重症及死亡有明显作用,对疫情防控具有重要意义。
科兴中维自2020年9月开始向国家药品监督管理局药品审评中心(CDE)滚动提交注册资料,药监局按照研审联动、随提交随审评的工作机制同步开展滚动审评。截至2021年2月4日公司共计滚动提交四十余次资料。在获得疫苗保护效力结果后,科兴中维按国家药监局的要求形成正式的Ⅲ期临床研究医学报告提交CDE,并于2月3日提出附条件上市申请。本次获得附条件批准上市是基于克尔来福境外Ⅲ期临床保护效力试验两个月的结果,暂未获得最终分析数据,有效性和安全性结果尚待进一步最终确证。
科兴控股董事长、总裁兼CEO尹卫东先生表示,“科兴中维研制的克尔来福在国内获批附条件上市标志着持续一年的‘克冠行动’取得了巨大的进展。我们对全球参与临床研究的所有志愿者表示深深的敬意,对主持和参与疫苗研究的各机构和研究者、支持‘克冠行动’的各级政府部门表示衷心的感谢。新冠疫情仍在全球持续蔓延,这场战‘疫’远未结束。我们期盼着早日提供更多安全、有效的疫苗,通过提高疫苗接种率最终控制疾病,让我们的社会和经济发展早日回到正常轨道,让我们早日摘下口罩,绽放笑容。”
科兴中维将继续积极推进克尔来福的Ⅲ期临床研究和附条件上市后的临床研究,以及在相关国家和地区的注册和应用,以期为全球新冠肺炎疫情防控和全球新冠疫苗的可及性、可担负性作出更大贡献,为饱受疫情冲击的世界注入信心,带来战“疫”胜利的希望。
关于克尔来福的保护效力
科兴中维研制的新冠灭活疫苗克尔来福前期经过了严格的动物实验和I、II期临床研究,目前国内已完成18岁以上成人和老人Ⅰ/Ⅱ期临床研究,3-17岁未成年人临床试验已完成全部受试者入组,国内受试者人数超过2200人,结果显示疫苗对各年龄人群均有良好的安全性和免疫原性。
科兴中维于2020年7月21日起陆续选择在南美洲的巴西、智利,东南亚的印尼和中东的土耳其这四个处于不同地域、各具特点的国家开展Ⅲ期临床研究。这几项研究使用同一批疫苗,按照相同的免疫程序(0,14程序),按药物临床试验质量管理规范(GCP)要求独立开展,总入组人数达2.5万人。
在巴西和土耳其两国开展的Ⅲ期临床研究分别评价了克尔来福在高危人群(接诊COVID-19患者的医务人员)和普通人群中的保护效力,两国均采用多中心、随机、双盲、安慰剂平行对照设计,主要终点为接种2剂疫苗或安慰剂14天后新型冠状病毒所致疾病(COVID-19)的发病率。
截至2020年12月16日,巴西针对18岁及以上医务人员的研究共入组12,396名受试者,获得253例监测期有效病例。按照0,14天程序接种2剂疫苗14天后预防由新型冠状病毒所致疾病(COVID-19)的保护效力为:对住院、重症及死亡病例的保护效力为100.00%,对有明显症状且需要医疗干预的新冠病例的保护效力为83.70%,对包括不需医疗干预的轻症病例在内的所有新冠病例保护效力为50.65%。
土耳其Ⅲ期临床试验目标人群为18~59岁处于高风险的医护人员(K-1)和处于正常风险的一般人群(K-2),截至2020年12月23日,K-1队列受试者入组918例,K-2队列入组受试者6453例,总计入组7371例,其中1322例受试者完成两剂接种并进入第二剂接种后14天观测期。基于29例病例的分析结果显示,按照0,14天程序接种2剂疫苗14天后预防COVID-19的保护效力为91.25%。
关于克尔来福的产能与供应
科兴中维的新冠疫苗生产质量管理体系已通过中国、巴西、印尼、智利等多国的GMP检查,上百批次的规模化生产证明疫苗生产过程可控、质量可靠。
科兴中维已建成并于2020年8月底投入使用的第一条新冠疫苗原液生产线年生产能力可达5亿剂。科兴中维已经完成第二条原液生产线的建设,预计今年2月份投入使用后将使克尔来福原液的年生产能力提高到10亿剂以上。目前我们正在进一步加快建设疫苗的原液和成品生产能力,力争让灌包装能力跟原液产能相匹配。
自去年底开始,公司陆续向开展临床研究合作国家巴西、印度尼西亚、土耳其和智利供应疫苗,像巴西、印度尼西亚、土耳其这样有疫苗灌包装能力的国家还可通过进口半成品的方式来快速获得疫苗。
成品和半成品两种形式的疫苗供应不仅缓解了当前公司灌包装能力不匹配的情况,节约了国际运输成本,也提升了疫苗的可及性和可负担性。
克尔来福接种的注意事项
1.目前暂未获得疫苗的保护持久性数据,接种后仍需根据疫情防控需要采取必要的防护措施。
2.目前该疫苗对60岁及以上人群的保护效力数据有限,疾病预防控制相关机构接种使用时,需结合该人群健康状态和暴露风险,评估接种本品的必要性。
3.该疫苗严禁血管内注射。尚无本品采用皮下或皮内注射的安全性和有效性数据。
4.使用前应检查包装容器、标签、外观、有效期是否符合要求,如玻璃针管有裂纹,玻璃针管外表面有斑点、污点、擦痕,标签不清或超过有效期时限及外观异常等均不得使用。
5.开启疫苗瓶和注射时,切勿使消毒剂接触疫苗。
6.该疫苗须置于儿童不可触及处。
7.接种现场应备有肾上腺素等药物和设备,以备发生严重急性过敏反应时急救用。在接种后应在现场观察至少30分钟。
8.该疫苗不能与其他疫苗在同一注射器内混合。
9.该疫苗严禁冻结。开启后应立即使用。
10.患急性疾病、慢性疾病的急性发作期、严重慢性疾病、过敏体质和发热者需慎用;必要时经医生评估后延迟接种。
11.糖尿病患者及有惊厥、癫痫、脑病或精神疾病史或家族史者需慎用。
12.患有血小板减少症或者出血性疾病者,肌肉注射本品可能会引起出血,需慎用。
13.尚未获得该疫苗对免疫功能受损者(例如恶性肿瘤、肾病综合征、艾滋病患者)的安全性和有效性数据,此类人群接种本品应基于个体化考虑。
14.注射人免疫球蛋白者应至少间隔1个月以上接种本品,以免影响免疫效果。
15. 尚未进行同期(先、后或同时)接种其它疫苗对本疫苗免疫原性影响的临床研究,同期接种其它疫苗时应咨询专业医师。
16. 接种本疫苗后出现任何神经系统不良反应者,禁止再次使用。
17.与其它疫苗一样,无法确保本疫苗对所有接种者均产生保护作用。
|
|