 | [中医][图文]清肺排毒汤正式处方来 |
 | [中医][组图]中医抗疫!广州市第八 |
 | [中医][组图]治疗不孕不育、颈椎病 |
 | [中医][图文]中药国际化重大突破: |
 | [中医]国家中医药局:这7个资格证是 |
 | [中医][图文]沉痛悼念国医大师邓铁 |
 | [中医]国务院修改《中药品种保护条 |
 | [中医]南方医科大学中西医结合医院 |
 | [新知]辉瑞/BioNTech新冠疫苗II |
 | [社会]卫健委又一副厅级干部被查 |
 | [中医][图文]余艳红:加快促进公 |
 | [养生保健]远离“老寒腿” 做好这几 |
 | [医药]构建五维“浸润式”中医药 |
 | [医药]天津新增1例无症状患者, |
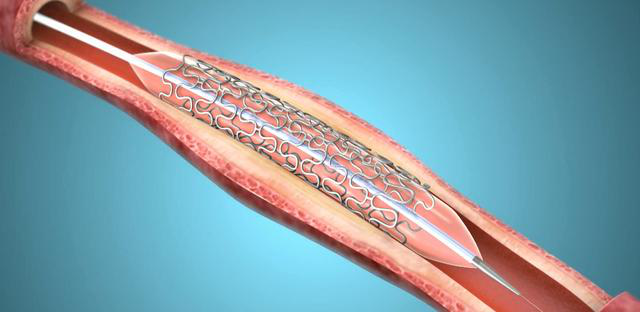
 | [调查][图文]心脏支架大降价从1 |
 | [中医][组图]如何挖掘好中医药这 |
 | [维权][组图]广州10余家医院被控 |
 | [医药][组图]新一期ESI公布:中 |
 | [医药][组图]女将挂帅!国务院督 |
 | [医药][组图]世卫组织强调新冠病 |
 | [医药][图文]【光明日报】南方医 |
 | [医药]国家开绿灯 这些医务人员 |
 | [社会][组图]玉林护士杀人碎尸, |
 | [调查]疫情冲击 近6成民营医院面 |
辉瑞/BioNTech新冠疫苗III期研究成功:保护效力达90%
|
文章导读:11月9日,辉瑞和BioNTech宣布,外部独立的数据监测委员会(DMC)在11月8日进行的第一阶段中期分析结果显示其mRNA候选疫苗BNT162b2在没有感染SARS-CoV-2病毒的健康受试者中证明了预防COVID-19的疗效。经过与FDA讨论后,两家公司选择放弃对32例病例的中期分析,并对至少62例病例进行了第一次中期分析。最终收集到的可评估病例总数达到94例,而DMC对所有病例都进行了首次分析。 |
对接种疫苗和接种安慰剂的人群进行分层分析后发现,接种第2剂BNT162b2疫苗7天后的保护率达到90%以上,意味着在接种BNT162b2疫苗后的28天即可获得有效保护。随着研究的继续,疫苗的最终保护效力可能会发生变化。DMC尚未报告任何严重的安全隐患,并建议该研究继续进行,按计划收集其他安全性和有效性数据。
BNT162b2疫苗基于BioNTech公司专有的mRNA技术开发,辉瑞则提供了全球疫苗开发和产能方面的支持。BNT162b2疫苗含有一种经优化的SARS-CoV-2全长刺突糖蛋白,这个蛋白是病毒中和抗体的靶标,可触发中和抗体以及TH-1优势的CD4+和CD8+T细胞的产生。BNT162b2疫苗目前正在全球超过120个中心(包括美国、巴西、南非和阿根廷等国家)开展III期试验,已经入组了大约37000例受试者,其中超过28000例已经完成了疫苗的第2剂接种。
BNT162b2疫苗的I/II期阶段研究的初步数据表明,所有年龄组受试者接种疫苗后耐受性良好,不良事件为轻至中度。经过检测受体结合域结合集合的IgG浓度以及SARS-CoV-2中和滴度发现疫苗可以产生剂量依赖性的免疫原性。此外,经BNT162b2接种免疫的受试者,其体内的T细胞可以识别SARS-CoV-2 病毒刺突蛋白的更多表位。
“今天对科学和人类来说是美好的一天”,辉瑞董事长兼首席执行官Albert Bourla博士说:“我们COVID-19疫苗III期试验的第一阶段分析结果提供了预防COVID-19的初步证据。在全球最需要的时候,我们的疫苗开发计划达到这个关键的里程碑。有了今天的结果,我们在帮助全球终结这场健康危机的道路上迈出了重要的一步。我们期待在未来几周内分享成千上万名参与者产生的其他疗效和安全性数据。”
BNT162b2的III期临床试验于7月27日开始,迄今已招募了43538例参与者,截至2020年11月8日,其中38955名受试者已接受了第二剂疫苗。约42%的全球参与者和30%的美国参与者具有不同种族和背景的背景。该临床试验正在继续进行中,预计将在总共164例确诊的COVID-19病例中进行最终分析。这项研究还将评估候选疫苗在先前接触过SARS-CoV-2的人群中提供针对COVID-19的保护的潜力,以及针对严重COVID-19疾病的疫苗预防。除了评估第二次给药后7天确认的COVID-19病例的主要疗效终点外,现在的最终分析将包括经FDA批准的新的次要终点,其基于第二次给药14天后的病例评估疗效剂量也是如此。两家公司认为,增加这些次要终点将有助于使所有COVID-19疫苗研究中的数据保持一致,并允许在这些新型疫苗平台之间进行交叉试验学习和比较。
10月6日,辉瑞/BioNTech宣布已经向欧洲药品管理局(EMA)提交COVID-19疫苗BNT162b2的滚动申请,EMA已经受理该申请并且人用药品委员会(CHMP)已经启动了滚动审评。在此之前,EMA已经在10月1日宣布启动了针对阿斯利康/牛津大学COVID-19疫苗AZD1222的滚动审评。
滚动申请和滚动审评允许申请人在临床试验仍在进行中时就提交部分已经获得的数据供监管机构审查,而不用像传统方式下提交上市申请那样等全部的疗效和安全性数据获得之后再提交,以加快临床急需药品和疫苗的批准进程。
|
|