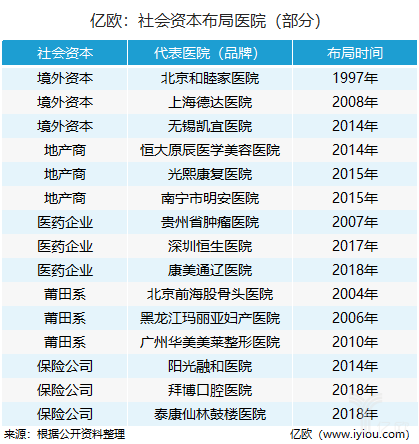
康芝药业迷雾:尼美舒利安全性再调查
|
文章导读: |
2.不良反应零通报质疑:漏报还是瞒报?
既然,央视及诸多的专业论文都证实过尼美舒利肝损伤的严重不良反应病例,为何康芝药业能提供“国家药品不良反应监测中心发布的《药品不良反应信息通报》,近十年无尼美舒利不良反应通报”的证据?
并且记者也并未在国家药品不良反应监测中心网站上搜索到尼美舒利的国内不良反应信息。对此,该中心不良反应监测处的工作人员告诉记者,是否通报不良反应国家药品不良反应监测中心内部有系统的评估体系,“解释起来一个星期也说不清楚,总之最终要评估风险和效益比”。
而一位与国家药品不良反应监测中心有过接触的药企高管则向记者透露,“某一种药品的不良反应情况,是否通报取决于该中心,而一旦不良反应情况被登记在国家药品不良反应数据库之后,信息将无法更改、删除。但不良反应监测中心网站上的内容则可以调整。”记者咨询多家公关公司人士也表示,“有办法将不良反应监测中心网站上涉及某种药品的不良反应信息撤除。”
因此,某种药品在《药品不良反应信息通报》中检索的有无,还需要明确其检索源是出自国家药品不良反应数据库,或仅是中心网站内容的搜索结果。从康芝药业多次公告或声明的内容来看,其强调的“经检索国家药品不良反应监测中心发布的《药品不良反应信息通报》(2001年11月~2010年3月),没有尼美舒利、对乙酰氨基酚、布洛芬三类药品相关不良反应的信息通报”,来源于
海南省药品不良反应监测中心2010年4月初对该公司查询申请的批复原文。在批复及公告中并未提及《药品不良反应信息通报》是否源自国家的数据库。而事实上,国家药品不良反应监测中心网站上披露的《药品不良反应信息通报》,除2010年月度数据完整外,其余年份仅见个别月份公布在线,数据的残缺自然难以得到真实的检索结果。对于此类细节问题,前述国家不良反应监测处的工作人员则表示,“没有接受咨询的义务,如是媒体采访请走相关程序。”
除证据来源存疑,记者注意到,国家药品不良反应中心披露的《药品不良反应信息通报》,其全面性和权威性同样透出诸多矛盾。
康芝药业招股说明书第84页披露,“根据广东省药品不良反应监测中心提供的数据显示,自2002年1月1日至2010年4月7日,在我国泛珠三角十省区域内,尼美舒利”的不良反应情况为:严重不良反应28例,一般不良反应1171例,合计1199例。其中,治愈628例,好转567例,有后遗症4例。
这与此前央视报道,“根据中国药物不良反应监测中心的数据,尼美舒利在中国上市的6年里,已出现数千例不良反应事件的发生,甚至有数起亡病例”不谋而合。此外,山西和河北的省药品不良反应监测中心日前也分别对当地媒体透露:从2004年至今,山西省已经发生了86例尼美舒利不良反应病例;河北2010年全省范围也接到59例关于尼美舒利用后的不良反应报告。最新消息则显示,郑州市药品不良反应监测中心表示,2010年郑州市有两例尼美舒利导致的不良反应;湖南省药监局相关负责人透露,曾接到尼美舒利不良反应报告,涉及片剂、胶囊、颗粒等剂型,未有死亡病例报告。
浙江省省药品不良反应监测中心办公室主任陈志根更向记者介绍,早在2007年,浙江就开始关注到“尼美舒利”的副作用。2010年,“尼美舒利”的副作用越来越明显,浙江对全省发出了警示,并建议主要医疗机构不再使用“尼美舒利”。2010年,浙江全省“尼美舒利”不良反应只有2例。2009年1月1日至今,浙江省共收到“尼美舒利”不良反应报告25例,严重的有4例,包括2例白细胞减少、2例肝功能损伤。然而,奇怪的是,记者在国家、广东、山西和河北省药品不良反应监测中心的网站上并未搜索到相关的报告或数据信息。
根据2004年3月4日发布的《药品不良反应报告和监测管理办法》(局令第7号)第六条第二款、第九条第四款和第二十四条之规定:国家食品药品监督管理局负责“通报全国药品不良反应报告和监测情况”; 国家药品不良反应监测中心履行“组织药品不良反应宣传、教育、培训和药品不良反应信息刊物的编辑、出版工作”; 根据国家药品不良反应监测中心分析评价结果,“国家食品药品监督管理局可以采取责令修改药品说明书,暂停生产、销售和使用的措施;对不良反应大或者其他原因危害人体健康的药品,应当撤销该药品批准证明文件,并予以公布”。
但前述提到的多处不良反应中心的数据均未被国家《药品不良反应信息通报》通报,也未有其他形式的公示,如果康芝药业提供的检索结果属实。相较于国外,比如爱尔兰6例肝损伤即可暂停销售的不良反应监测情况,在尼美舒利问题上,不良反应的监测记录成了只有不良反应监测中心内部人员掌握的“特权”资料或只有在专业会议才能披露。
又或者说,在国内的监测体系下,20例公开的严重肝损伤等不良反应,至少2人死亡的事实都不足以上升到载入《药品不良反应信息通报》向全国公开发布的地步?而在2006年12月4日,《中国医学论坛报》披露,葡萄牙波尔图Geral de Santo Antonio医院Teixeira等报告,一例50岁妇女发生急性泛发性发疹性脓疱病(AGEP),被认为与服用尼美舒利有关。“研究者认为,医学文献中之前尚未有关于尼美舒利诱发AGEP的报告,建议将尼美舒利加入可导致这种严重不良反应的药物名单中。”
似乎,国内的数千尼美舒利不良反应病例在公开的急迫性上都抵不上葡萄牙的一例AGEP。
是漏报还是另有隐情,又或者是国内现行的药品不良反应监测体系有待改进?但是,仍然有部分的省市监测中心在其网站公开了尼美舒利导致不良反应的案例。
江苏省药品不良反应监测中心网站披露,一女患者因骨质增生《口服尼美舒利致下肢浅静脉炎1例》,发生时间为2005年。安徽省食品药品监督管理局网站则有三次不良反应信息披露:《安徽省第三季度ADR信息分析及用药安全提示》一文指出,该省药品不良反应监测中心2005年第三季度共收到2448份药品不良反应病例报告表,其中镇痛药为79例次,包括口服尼美舒利片(合并用药阿奇霉素、阿米卡星)引起急性肾衰竭;安徽省《宿松县2007年上半年新的药品不良反应报告浅析》也表示,该县共计收到新的药品不良反应报告57例,尼美舒利分散片为2例;《马鞍山市2008年药品不良反应监测数据分析报告》(马药监测中心[2009]2号)透露,该中心2008年上报的1639份不良反应报告中有一例为尼美舒利分散片引发。
郑州市儿童医院儿科副主任医师高丽等医生则向记者介绍,通过临床,一些用过这种药的儿童肝肾会有损伤。“近几年,我们医院不用这种药了,因为副作用比较大。”
综上所述,业内人士强调,在多方证据表明国内已经有较多的尼美舒利不良反应,以及引发严重肝损伤病例存在的前提下,人们有理由怀疑康芝药业单方面提供的《药品不良反应信息通报》检索结论的可靠性和权威性。
2月14日晚间,记者以家长身份在深圳市多家药店寻访时,一位大型药店的药剂师直言,“实际上,我一直不主张儿童退烧用尼美舒利,在尼美舒利的不良反应问题上,我觉得我们国内是被掩盖的。”
3.国药准字:郑筱萸给的准生证?
尼美舒利的不良反应是否被掩盖已经不重要,进一步的调查记者发现,康芝药业瑞芝清在审批为儿童发热用药时就存在某种巧合。
记者注意到,人民卫生出版社出版的《新编药物学》里面对于尼美舒利的注解是:主要用于类风湿性关节炎和骨关节炎、痛经、手术后痛和发热,上面并没有标注可用于儿童。而记者购买的瑞芝清的说明书中赫然标注“儿童用药仅用于1岁以上儿童,儿童常用剂量为每日5mg/kg,分2-3次服用”。
那么,欧盟全面禁止12岁以下儿童、美国未批准在儿童中使用的尼美舒利,为什么在中国可用于儿童,甚至初生的婴儿?
康芝药业在澄清公告中强调了其药品的合法性,称“瑞芝清(尼美舒利颗粒)是国家食品药品监督管理局(SFDA)批准生产和销售的处方药,批准文号为:国药准字H20020137。公司严格按照GMP要求生产,质量符合国家药品标准”。然而,从批文上可以看出,瑞芝清作为儿童用药的审批时间为2002年,而这正好是已被处决前药监局局长郑筱萸主政期间。
公开信息显示,法院指控郑筱萸在1997年6月—2006年12月担任国家药监局局长等职务期间,利用审批权,为8家制药企业在药品、医疗器械的审批等方面谋取利益;更于2001年到2003年,擅自批准降低药品审批标准,经后来抽查发现,包括部分药品生产企业使用虚假申报资料获得了药品生产文号的换发,其中6种药品竟然是假药。2006年齐齐哈尔第二制药有限公司(齐二药)亮菌甲素注射液事件,以及安徽华源生物药业有限公司“欣弗”注射液事件,导致十人死亡,多名病人出现肾功能衰竭。不久,郑筱萸被中纪委“双规”,并于2007年7月10日上午在北京被执行死刑。
巧合由此产生,康芝药业瑞芝清正好是在郑筱萸擅自降低药品审批标准的期间被批准,并且被作为治疗儿童发热的主打药销售。需要强调的是,在瑞芝清治疗儿童发热快十年后的今日,除穷人沦为试药工具的印度外,记者也没能找到国外关于尼美舒利在儿童发热适应症上的任何临床试验文献或数据,更没有找到过国内关于尼美舒利治疗儿童发热病症的任何一期临床试验文献或数据。现有能找到的国内尼美舒利治疗发热的论文均为2005年以后的临床观察报告。
这是极其诡异的事情,医药界人士告诉记者,“在国外一种成熟药物需要增加新的适应症,都必须经过长达几年的试验论证,并需经过监管部门的严格审批。”国内的制度同样如此。根据我国《药品注册管理办法》(局令第28号)等法规的相关规定,新药注册一般需经过临床前基础工作、新药临床研究审批、新药生产审批等阶段。“仿制药应当与被仿制药具有同样的活性成分、给药途径、剂型、规格和相同的治疗作用。已有多家企业生产的品种,应当参照有关技术指导原则选择被仿制药进行对照研究。”“对于已上市药品改变剂型、改变给药途径、增加新适应症的药品注册则按照新药申请的程序申报。”
比如,2009年11月10日亚宝药业(600351,股吧)(600351.SH)就曾公告称,公司忍冬感冒颗粒对甲型H1N1 流感病毒治疗效果与卫生部推荐药物达菲相当。但随后被媒体证实新增药效尚未完成试验。
而尼美舒利的适应症,2006年欧盟更新尼美舒利制剂说明书注明适应症为“急性疼痛的治疗、疼痛性关节炎的症状治疗、痛经”,其后欧美药品管理局的多次安全审查中也只被提及“急性疼痛、骨关节炎疼痛症候和原发性痛经”,均未提及发热,更不可能明确儿童发热。在国内,尼美舒利治疗发热适应症被明确是在2008年,该年6月国家食品药品监督管理局修改尼美舒利口服制剂说明书时,较旧版适应症新增“本品为非甾体抗炎药,具有抗炎、镇痛、解热作用”。一位医生朋友告诉记者,在2007年时,广东白云山制药总厂生产的尼美舒利说明书就强调:该药的“儿童用药安全性尚未建立”。
由此可见,在国内,尼美舒利治疗儿童发热为事后追认的适应症,在法律程序上本末倒置了,比如瑞芝清应该先由2002年批准发热适应症再临床推广,实际却变为2002年临床推广多年后2008年才被批准治疗发热。并且,这种既成事实的推广并未实施临床试验。
作为取得批准文号较早的药品,康芝药业在介绍瑞芝清时同样缺少临床试验数据部分。在招股说明书中,瑞芝清有关临床试验的内容只有第18页的“对胃肠道的副作用小,耐受性好,在治疗儿童发热各种症状的临床试验中的疗效与对照药相比具有效果快、作用强、维持时间长、安全可靠等优点,已越来越受到医生和患者的认可”;以及第80页的“在近年来对这三种系列药品进行对比研究的临床学术文献中认为,尼美舒利在治疗儿童发热各种症状的临床试验中要优于对乙酰胺基酚和布洛芬,具有效果快、作用强、维持时间长和安全可靠等优点,值得推广”,从表述来看明显地将后期的临床运用经验归结为前期临床试验数据。
一种擅自增加儿童发热适应症,且适应症没有得到国家法规承认,更没有临床试验数据支撑,又正好是郑筱萸擅自降低药品审批标准期间,如此的国药准字,与郑筱萸的关联恐怕并非巧合吧。
根据《药品注册管理办法》第126条规定,未按照要求完成IV期临床试验的、未按照规定进行药品不良反应监测的、经国家食品药品监督管理局再评价属于疗效不确、不良反应大或者其他原因危害人体健康的、按照《药品管理法》的规定应当撤销药品批准证明文件的、未按规定履行监测期责任的等情形的药品批准文号到期将不予再注册。或许,以瑞芝清等为代表的儿童退烧药尼美舒利,在未来都可能面临无法注册的风险。
|
|