| [中医][图文]余艳红已担任国家中医 |
 | [中医]国务院办公厅关于印发中医药 |
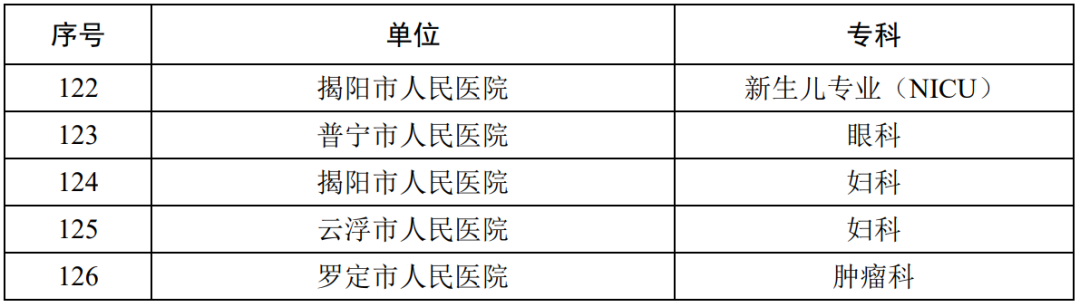
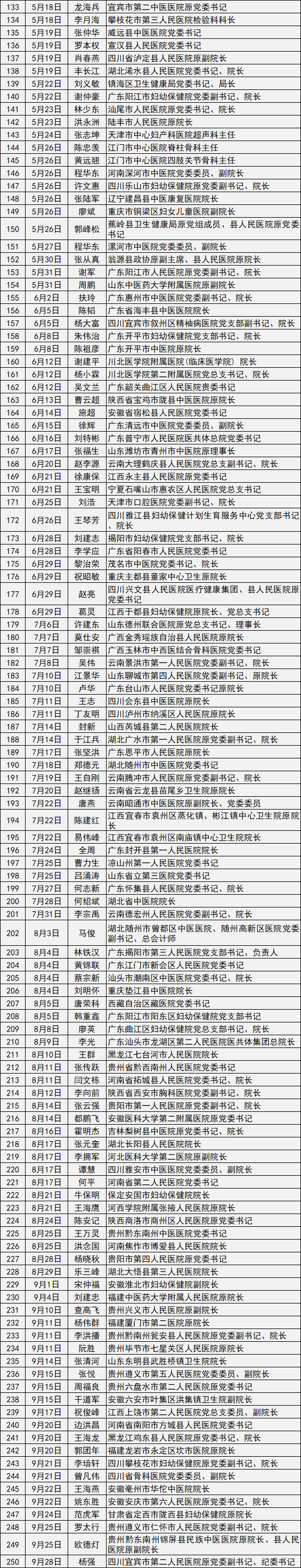
 | [中医]中医院学科专科学术影响力排 |
 | [中医][图文]国家中医药管理局党组 |
 | [中医][图文]王永炎院士:做立大志 |
 | [中医][组图]喜讯!广东新增1名国医 |
 | [中医]2022年全国名老中医药专家传 |
 | [中医][图文]余艳红:充分发挥中医 |
 | [社会][图文]奇迹!美国男子接受 |
 | [名家医案]李晶教授治疗复发性口腔溃 |
 | [女性保健][组图]和男朋友去泡温泉后 |
 | [方药研用][组图]治疗口腔溃疡潜力中 |
 | [纪检]划重点:中纪委点名带金销 |
 | [医药][图文]广州医科大学纪委书 |
 | [女性保健]痛经是什么原因?切勿“习 |
 | [优生优育]小儿便秘,中医治疗有妙招 |
如何应对《欧盟传统草药产品指令》过渡期满后的挑战
|
文章导读: |
如何理解《指令》七年过渡期及目前在欧盟一些国家实施的情况
由于《欧盟传统草药产品指令》(2004/24/EC)属于指令性法律文件,必须有待各成员国转化成本国法律法规后才能在欧盟完全贯彻执行。对于指令,相关成员国应进一步细化为成员国的相应法规,以达到指令所要求的目标,而且具体方法和措施,相关成员国需要根据本国实际情况灵活制定。因此,《指令》规定了7年的过渡期,以便各国贯彻实施《指令》有关规定,但并不是说,7年过后,所有符合条件的传统医药产品注册的大门从此关闭,这不是《指令》的初衷。
欧盟颁布《指令》的初衷是为了维持传统草药产品的上市销售,但欧盟各成员国制订了不同的程序和规章,而这些程序和规章内容差别很大,阻碍了传统药品在欧盟内部自由流通,也造成了传统药品生产企业的不公平竞争。为了解决上述问题,欧盟决定制定单独的传统药品注册法规,即《欧盟传统草药产品指令》(2004/24/EC)。
该《指令》于2004年4月30日正式生效,2005年10月开始在欧盟成员国开始实施以来,各成员国实施进展不一。已有249个传统药产品在欧盟各国获准传统药品注册,其中英国已有100个产品注册,但至今还没有传统中药制品获准注册。以英国和德国最为迅速,德国是首先注册传统药的国家,英国则是注册传统药最多的国家, 其它如芬兰、荷兰、瑞典等国也相继注册。注册的传统药以单味药和欧洲传统药为主,但也有一些复方制剂和非欧洲传统药获得注册,这些非欧洲传统药和复方制剂的成功注册为传统中药制剂注册传统药提供了一些借鉴经验。
英国是欧盟使用传统中药的主要国家之一,对贯彻执行指令十分重视,制订了本国的“传统草药登记方案”(Traditional Herbal Medicines Registration Scheme,简称:THMRS),根据英国公布具体措施和信息,概括要点如下:
一是只管工业化生产的草药产品(含中成药),不管草药饮片和中医师自制的产品。中药饮片和医者自制自用的中药制品, 仍归1968年英国药品法第12 (1)条款管辖而继续享有执照豁免, 因而在今年4月底之后仍然可以合法使用。
二是依照《欧盟传统草药产品指令》规定于2005年10月制定了传统草药产品注册办法(THR), 给予在欧盟使用30年以上,或欧盟使用15年,非欧盟国家使用30年以上的草药产品以“简便优惠”的注册。然而,THR 要求对产品的每一成分进行检测,这对多成分的复方中成药产品很难实现,因而不适用于中成药。迄今没有一个中成药THR 注册成功,今后几年内也不太可能。
三是4月底之后,未注册草药产品在英国的生产、进口和批发将被禁止,而零售可以继续,直到产品的库存售完或有效期截止。零售商只能销售4月30日之前进货的草药产品,而4月30日以后进货未注册草药产品则属违法, 一经查出将被惩处。
四是《指令》的5.1条款规定,授权的保健职业者(authorised healthcare professions)可以委托第三方加工特定的非执照或未注册草药产品供自己的病人使用,这类似于医院内部使用的“协定处方”。一旦中医草药行业得以立法管理,中医师就拥有了“授权的保健职业者”的地位,因而可以委托加工中药产品。这是中医师可以继续使用未注册中成药的唯一可行途径,但前提是中医必须通过立法注册得到认可。
五是对“产品”和“成分”有明确的定义。凡成品批发进货后未经再加工配制而直接给病人使用的是产品,将被欧盟指令管制;凡未经加工的草药原材料(如中药饮片),或虽经加工提取(如草药酊剂,提取物),但是批量进货经过配置后才给病人使用的是成分,因而不受欧盟指令管制。以此理解,单味中药浓缩粉供配方使用,因而是成分而不会受管制;而浓缩粉剂型的已经配制好的成方直接给病人使用则是产品,会被管制。
根据《指令》的规定,传统使用年限要求产品必须具有30年以上的使用年限,包括至少15年在欧盟国家使用的年限。按此推算,中药产品必须最晚在1996年开始在欧盟销售,1981年开始在其它国家上市销售才能符合条件现在注册。不足“15年欧盟+30年使用”的产品则必须等到满“15年欧盟+30年使用”后才可以注册。这对于欧盟本国的成立不久的传统医药生产商也是一个挑战。据了解,芬兰本国的传统医药企业,有不少是没有30年的产品销售历史,《指令》的实施,将会造成包括芬兰在内近十万欧盟中医药从业者的失业,这将会给欧盟带来不稳定因素,因此,芬兰相关企业正在积极推动芬兰政府延迟实施《指令》。
《指令》过渡期满后中药在欧盟面临的形势与挑战
《欧盟传统草药产品指令》实施后对于中医药欧洲发展的基本评估是《指令》为传统中药以治疗药品身份进入欧盟药品市场提供了法律依据,如果中药在欧盟注册成功,将使中药进入欧洲主流植物药市场和欧洲药品分销渠道提供了可能。这将大大扩大欧洲中药市场,规范目前分散零乱的欧洲中成药市场,保证中成药质量,提高中药的声誉,是中药在欧洲正常健康发展的一个难得机会。但不利的是也将含有动物、矿物成分的传统医药拒之于欧盟门外。《指令》实施后,在一定时期内欧盟本土的一些传统医药生产企业也难以符合《指令》要求,将会导致欧盟传统医药生产企业员工面临失业;同时,由于没有注册的中成药在一些国家不能销售,也会导致药店经营者倒闭失业;《指令》限制了中成药在欧盟的使用范围,欧盟一些国家会出现“有医缺药”的现象,因缺乏中成药进而会影响中医对一些疾病的疗效,从而也将进一步影响中医药的传播。
需要说明的是欧盟所说的草药,通常是指“成药”,它有经批准的包装,明确指出药品用法、用量、用药时间等。
《指令》过渡期满后中药在欧盟面临的形势
一是与欧盟谈判的价值和《指令》延期实施的可能性。
有人认为应与欧盟谈判,将《指令》规定过渡期延长至2019年。《指令》涵盖的传统医药注册范围,不仅是对中国和其它国家的传统医药,也包括欧盟本土的传统医药,没有构成歧视外国传统医药产品的嫌疑。作为欧盟一个法令出台或修改,需要经过较长一段时间,需要各成员国的协调一致。目前开展谈判,对于中药注册的价值不大。因为谈判成功需要漫长时间,而且还不一定能成功,即使等到谈判成功,一些中药品种“传统使用”注册期限已到,已不需要通过谈判来解决。
二是《指令》过渡期满后中药在欧盟的注册之门并没有关闭。
《欧盟传统草药产品指令》的主要特点就在于统一了欧盟传统草药上市要求,制订了一种新的传统草药上市途径,既体现了尊重历史和传统的管理理念,设立了新的草药产品委员会,协调各成员国草药登记上市过程中出现的问题,并负责制定欧盟草药专论或欧盟原料名单。
“目前委员会已经公布了50 多部专论(http://www.ema.europa.eu),接下来几年,在共同评估的基础上,会有更多的专论公布。到现在,这些专论已经描述了中国和印度正使用的草药产品,这是热点,同样也将是对中国科学家和生产商的要求。这些都为传统中药产品在欧盟登记上市提供了机遇。”(欧盟官员讲话)2011年4月30日是传统草药过渡期的最后期限,获得登记的中药产品可以在4月30日后继续销售,但登记注册程序并没有从此关闭,在4月30日可以继续申请登记上市,但在没有获得登记之前,不能在市场上销售。
欧盟各个成员国实施《指令》情况不同。法国卫生部会发布一份可食用的草药名单,列入此名单的草药可以作为食品补充剂使用,反之则非法;比利时等国则有一份可食用名单,一份不可食用名单,介于两者之间不可食用的就需要申请。荷兰政府在执行《指令》时相对宽松,在不注明功能主治的情况下,中成药还可以按食品补充剂销售。荷兰神州天士力医药集团是欧盟成立较早的中药贸易公司,保留着较完善的产品贸易记录,除动物药和含有濒危动植物药成份药外,截止到2010年有180个传统中药产品在欧盟使用的凭证,随着时间推移,将有更多品种可供提供注册。这些资料可以帮助国内医药企业在荷兰及欧洲的注册,提供“传统使用”证据。目前,荷兰神州天士力医药集团的产品覆盖了欧盟主要中药产品消费国。因此,一些媒体认为无法提供15年“传统使用”证据,希望中国政府与欧盟谈判,这是对情况没有全面掌握,是对形势的误判。
在过渡期内,在欧洲很多国家,中成药销售也不被允许。例如瑞士对食品要求极严,只有中药饮片出售。西班牙、意大利和德国等南欧国家也不能销售中成药,这些国家的消费者可以到比利时和荷兰购买或邮购中药,因为这两个国家规定在不注明中药的主治功能的情况下,还可以继续以食品补充剂销售。所以,欧洲从此“有医无药”之说有些夸张。