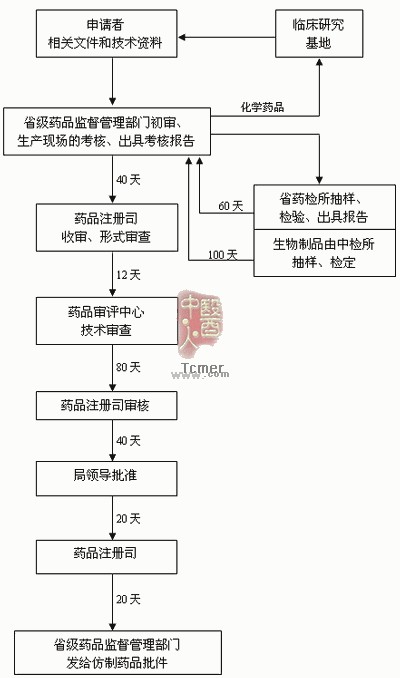
仿制药品注册审批流程图及报送资料
仿制药品申报资料
仿制药品申报资料
一、 中成药
(一)处方:须与被仿制的中药成方制剂(如果被仿制药品为中药新药应提供正式标准)完全一致。
(二)生产工艺应与被仿制药品相同并提供详细工艺路线及生产条件。
(三)质量研究资料:应能达到被仿制药品各项测试的要求。
(四)稳定性研究资料:按照《新药审批办法》有关稳定性研究要求对仿制药品进行稳定性考察。
(五)质量标准及连续试制3批样品的自检报告。
(六)使用说明书。
(七)标签及包装材料。
二、 化学药品
(一)原料药(包括辅料):
1、结构确证资料:确证化学结构或组份的试验数据、图谱及对图谱的解析,与被仿制药品进行各项测试对比。对于不能用理化手段测定结构、纯度的药品,其原材料和生产工艺应与被仿制药品相同。
2、生产工艺资料:包括制备方法的来源或依据、反应条件、制备工艺及精制方法、所用化学原料的来源及标准,动、植物原料的来源、学名、药用或提取部位,抗生素的菌种及培养基等。
3、质量研究资料:与被仿制药品进行各项测试对比,包括有关晶型、异构体及生产工艺中带入的原标准规定以外杂质和质控数据等。
4、稳定性研究资料及有效期的确定。
5、质量标准及连续试制3批样品的自检报告。
6、包装及标签。
7、必要时,提供安全性的有关资料。
(二)制剂
1、处方:说明原、辅料的来源并提供质量标准,对特殊辅料在处方中所起的作用应加以说明。
2、生产工艺资料。
3、质量研究资料:与被仿制药品进行各项测试对比,提供影响药品生物利用度的有关口服固体制剂及其它剂型的溶出度、释放度等资料。