通过几十年研究已经明确了宫颈癌的发生与高危HPV病毒感染密切相关,随着宫颈癌筛查的广泛开展,明显降低了宫颈癌的发病率,很多早期宫颈癌及癌前病变被发现,准确的病理诊断及分级对于临床下一步的治疗及处理至关重要。近年来,有关宫颈癌前病变的命名及分类发生了一些变化,本文将重点介绍这些变化以及对于病理诊断及临床处理上的影响。
通过几十年研究已经明确了宫颈癌的发生与高危HPV病毒感染密切相关,随着宫颈癌筛查的广泛开展,明显降低了宫颈癌的发病率,很多早期宫颈癌及癌前病变被发现,准确的病理诊断及分级对于临床下一步的治疗及处理至关重要。近年来,有关宫颈癌前病变的命名及分类发生了一些变化,本文将重点介绍这些变化以及对于病理诊断及临床处理上的影响。
一、宫颈鳞状上皮癌前病变
目前我们对于宫颈鳞状细胞癌癌前病变使用最广泛的病理诊断术语是宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN),并且将其分为三级,即:CIN1,CIN2和CIN3, 其中CIN3级包括了以往的鳞状上皮重度不典型增生与原位癌(carcinoma in situ,CIS),这一命名系统旨在描述宫颈鳞状上皮由异常增生向癌变方向发展的连续性形态学改变过程[1]。从2003年WHO分类正式推出,应用已经10余年了,虽然CIN命名系统较好的指导了临床下一步的处理,但是在应用中也发现了一些问题。首先,CIN诊断术语将其定义为瘤变(neoplasia), 即认为无论其分级如何,都是肿瘤性病变。但是,实际上在HPV感染所导致鳞状上皮病变中,有相当一部分是一过性感染(如CIN1级病变),它们大多为自限性且可消退。因此,将它们统称为“瘤变”并不合适,特别是当临床医生以及患者不能理解病变的真正性质时,可能会导致过度治疗以及患者不必要的精神负担。其次,在病理诊断中,对于CIN2级病变诊断的重复性较差,也就是说不同病理医生之间,或是同一名医生在不同时间对于CIN2级病变的诊断差异性较大(Kappa值低),有文献报告,不同病理医生对于CIN2级病变的诊断一致性仅为43%[2]。此外,从临床目前规范的宫颈病变处理的流程来看,CIN1患者仅需进行随访观察,而CIN2以上的患者则需根据情况进行临床相应的处理。从细胞学筛查诊断上,宫颈细胞学涂片的分级系统(Bethesda系统)对于鳞状上皮病变采用的是两级分类。
基于以上的考虑,近年来逐渐在国际上倾向采用更加简单的两级分类法对宫颈鳞状上皮癌前病变进行描述和诊断,2012年美国病理学会(CAP)和美国阴道镜及宫颈病理学会(ASCCP)联合发表了下生殖道HPV相关的鳞状病变的命名标准化计划(The Lower Anogenital Squamous Terminology Standardization Projectfor HPVAssociated Lesions),简称为LAST计划,在这项计划中提出了对于包括宫颈在内的下生殖道HPV感染相关的鳞状上皮病变进行命名的修订,推荐采用鳞状上皮内病变(squamousintraepithelial lesion,SIL)来命名,并且将其分为两级:即低级别鳞状上皮内病变(Lowgrade suamous intraepithelial lesion, LSIL)和高级别鳞状上皮内病变(High grade suamous intraepithelial lesion ,HSIL)[3]。2014年出版的第四版WHO女性生殖系统分类中,在宫颈鳞状细胞癌前病变中采用了这一命名方案, 其中LSIL的同义词包括:宫颈上皮内瘤变I级(CIN1)、轻度非典型性增生、扁平湿疣以及挖空细胞病等,而HSIL同义词包括:宫颈上皮内瘤变II级(CIN2)、宫颈上皮内瘤变III级(CIN3)、中度非典型性增生、重度非典型性增生以及鳞状上皮原位癌[4],见表1。

鳞状上皮内病变的两级分类方案这样的分类,简便实用,使得病理诊断的重复性提高,并且也使得组织学分级与细胞学分级相互对应。更为重要的是该分类方案较好地反映了HPV相关病变的生物学过程,能更好地指导临床处理及预后判断。80%左右LSIL由高危型HPV感染(HPV16和18型为主)所致,剩余的病例为低危型HPV感染(HPV6和11型),且多数病例为一过性感染,大量的回顾性研究显示,经过活检证实的LSIL整体预后良好,大部分病例会在一年之内消失;而在HSIL中超过90%以上的病例感染的是高危型HPV,且研究数据显示,如果不经过恰当的治疗,大约1/3HSIL可以在30年间进展为癌[4]。因而,对于病理诊断为LSIL,可随诊,不需要进行手术切除宫颈,而HSIL则需要进行临床治疗。
虽然新的命名及分类具有上述优点,但是在病理诊断中也需注意,在LAST计划中并非简单的将CIN2病变直接归入HSIL中,因为很多以前所诊断CIN2病变包含部分LSIL及部分HSIL。如何区分两者,近年的研究显示通过免疫组化染色检测p16的表达情况,对于区别两者有帮助。p16是一种细胞周期蛋白依赖性激酶抑制剂,参与细胞周期的调控。在HPV持续感染所致的高级别病变中p16呈连续大块状深棕色染色,而低级别病变p16可以阴性、或局限在中间及表层,因而在以下病理诊断情况下推荐使用p16免疫组化染色:①病理诊断需鉴别是HSIL还是不成熟鳞化、萎缩、修复性上皮增生等类似肿瘤病变时;②病理组织学考虑CIN2病变时;③细胞学或是HPV检测有高危病变的可能性,但组织学没有发现明显病变时。
此外,虽然在临床处理时,对于大部分HSIL进行宫颈切除手术,但是对于年轻女性,特别是未完成生育的女性,涉及保留生育功能,并且研究显示部分CIN2可能消退,因而不必都行宫颈切除,故在病理诊断中区分CIN2和CIN3仍有一定临床意义,现阶段建议在病理报告中将两种命名方案都可列上,例如HSIL(CIN2),或是HSIL(CIN3)等,以便于临床进行个体化的治疗。
二、宫颈腺性病变
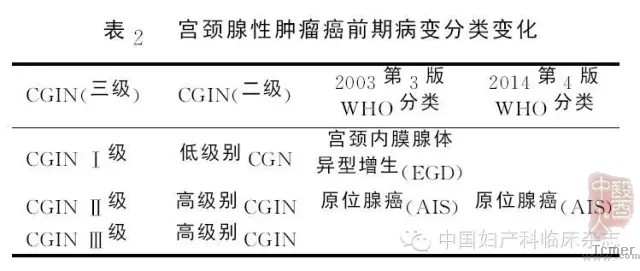
随着宫颈病变的增加,宫颈病变筛查的范围扩大,宫颈腺性病变也越来越多的引起人们的关注。2003年第三版WHO分类将宫颈腺上皮前驱病变命名为:宫颈内膜腺体异型(非典型)增生(Endocervical glandular dysplasia ,EGD)和原位腺癌(Adenocarcinoma in situ, AIS)[5],也有学者将浸润前期病变命名为宫颈腺体上皮内肿瘤(Cervical glandular intraepithelial neoplasia ,CGIN),有将其分为三级的:CGIN1,CGIN2及CGIN3,也有将其分为两个级别:低级别CGIN(low grade CGIN ,LCGIN)和高级别CGIN(Highgrade CGIN, HGCGIN)[6]。
而2014年第4版WHO分类对于腺上皮前驱病变的命名做了调整。仅将原位腺癌(adenocarcinoma in situ, AIS)列入前驱病变中,并将其定义为:这是一种具有恶性表现的腺上皮内病变,如果不治疗,具有明显进展为浸润性腺癌的风险[7]。与之同义的名称是高级别CGIN(HGCGIN),而第三版中的宫颈内膜腺体不典型性或低级别CGIN,在此次分类中没有单独列出,只是在AIS中提及,并指出这类病变,由于诊断标准界定不清楚,可重复性差,目前临床尚不做进一步处理。 如果在病理活检中见到这类病变可以加做p16、Ki67、ER及PR免疫组化染色,当病变显示明确的p16弥漫阳性、Ki67增生指数高且缺乏雌孕激素受体的表达,则认为是形态不完全的AIS,临床应该按照AIS来处理。新版WHO分类在AIS中提出了一个新的病变:产生粘液的复层上皮内病变(stratified mucinproducing intraepithelial lesion, SMILE),属于AIS的变型, 临床处理上同AIS(表2)。
从临床治疗角度,病理活检明确诊断为AIS的病例,应行Leep或是锥切,完整送病理检查,病理应连续12点取材,关注病变是否为多点及跳跃性病变,切缘是否有病变累及。对于已经完成生育且不再有生育要求的妇女,建议行子宫切除。对于保守治疗的患者,应进行包括阴道镜、细胞学及HPV检测在内的密切随访。
总之,有关宫颈癌前病变的新的命名及分类变化,较完整的反映宫颈病变的性质,简化了分级,提出了一些辅助诊断标记物,使得病理诊断准确性及重复性提高,利于临床进一步的处理。目前,仍是学习及推广阶段,现阶段在应用新的名称及分类时,尽量标明传统分类的名称,如在诊断SIL时,相应的“IN”名称及分级也应注上,以便于临床逐步理解及掌握。