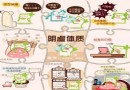
慢性肾脏病血脂谱特征
慢性肾脏病(CKD)患者的高脂血症主要表现为甘油三酯(TG)、脂蛋白残余颗粒[ 乳糜微粒残余颗粒、中间密度脂蛋白(IDL)]、小而密低密度脂蛋白(sdLDL)、脂蛋白(a)[LP(a)]水平升高,高密度脂蛋白胆固醇(HDL-C)水平降低,而低密度脂蛋白胆固醇(LDL-C)水平升高尽管在腹透和肾病综合征患者中比较常见,但并非CKD 的特征性改变(表1)。
高甘油三酯血症
TG 主要存在于乳糜微粒(CM)和极低密度脂蛋白(VLDL) 中, 在CKD 早期即可升高,尤其是肾病综合征和腹膜透析患者。CKD 患者VLDL 合成增加且存在清除障碍;多种毒素导致一些重要酶的活性和基因表达异常,如脂蛋白脂酶、肝脂酶活性降低,低密度脂蛋白受体相关蛋白(LRP) 表达下调,酰基辅酶A:胆固醇酰基转移酶表达增加;胰岛素抵抗和继发性甲状腺功能亢进可能通过抑制脂蛋白脂酶合成参与TG 的代谢异常,这些均被认为是非透析CKD 患者高甘油三酯血症的主要发病机制。
然而,透析患者不仅酶消耗增多,酶的比值如载脂蛋白C Ⅲ(ApoC Ⅲ )/ApoC Ⅱ 也升高。脂蛋白分解代谢不完全导致残余颗粒(CM 残余颗粒、IDL)增多,由于其易与ApoE 结合,而ApoE 又是血管壁LRP 的配体,故长时间暴露于富含残余颗粒的脂蛋白增加动脉粥样硬化风险。
高密度脂蛋白胆固醇水平降低
CKD 患者HDL-C 水平下降、成熟受损。ApoA Ⅰ和ApoA Ⅱ(HDL 的主要构成成分)水平降低,导致卵磷脂胆固醇酰基转移酶和肝脂酶活性下降,游离胆固醇酯化受损和HDL3 向HDL2转化率降低。故HDL 携带胆固醇的能力降低,使外周胆固醇向肝脏转移减少,胆固醇在血管沉积增加,促进动脉粥样硬化。
对氧磷酶是HDL 的重要组成,可抑制LDL 氧化,CKD 患者对氧磷酶活性降低,可能导致LDL 甚至HDL的氧化,而感染或尿毒症相关炎症反应可能引起HDL由抗氧化因子向促氧化因子转变,这些都易导致动脉粥样硬化。
低密度脂蛋白胆固醇水平升高
LDL-C 升高是肾病综合征的特点, 但并非进展期CKD 和血透患者的典型特点。sdLDL 和IDL 都具有很强的致动脉粥样硬化作用, 其中sdLDL 是LDL 的亚型, 具有很强的血管壁渗透性,并容易被氧化而诱发动脉粥样硬化。IDL 是VLDL 的中间代谢产物,伴随着TG 的脂肪酶代谢可被进一步降解为LDL。血液透析患者TG 脂肪酶活性降低,IDL 向LDL 的转化减少,IDL 蓄积,IDL、sdLDL 与巨噬细胞的亲和力强,促进其更易进入血管壁加剧泡沫细胞和粥样斑块的形成。
IDL 和LDL 在血液中停留时间延长,增加了作为载体的ApoB 被氧化、氨基甲酰化和糖基化的概率,使其与肝脏LDL 受体或LRP 的识别、结合更加困难,更不易被清除。研究显示,血液透析患者LDL 的停留时间是非尿毒症患者的2 倍,且由于此情况下LDL 生成同样受到抑制,故血清总水平可能表现为正常。由于在肝脏清除受损,被修饰的LDL,如氧化低密度脂蛋白(ox-LDL)、丙二醛化的LDL更易被巨噬细胞摄入,并加剧其向泡沫细胞转化和粥样斑块形成。
脂蛋白(a)水平升高
LP(a)是心血管病的独立预测因子, 与LDL 结构相似,因含有ApoA 和通过二硫键相连的ApoB100 而不同于LDL 。由于ApoA与纤溶酶原结构相似 可以竞争性地与纤溶酶原受体、纤维蛋白原、纤维蛋白结合。
LP(a) 水平由ApoA 的基因型决定,即与ApoA 亚型的的分子量呈负相关。根据ApoA 基因包含的环形结构域- Ⅳ重复序列的多少,ApoA 可表现为不同亚型,分子量从300 至>800 kDa不等。ApoA 亚型的分子量越高,LP(a) 的血清水平越低。不同个体的亚型表现不同,研究发现,对于CKD1 期患者, 只有在高分子量ApoA 为主要表型时,LP(a)水平才升高,并早于肾小球滤过率(GFR)减少出现;肾病综合征和腹膜透析患者无论表型如何,LP(a) 水平均升高;在肾移植者中,接受血液透析者只有高分子量表型者LP(a)水平下降,接受腹膜透析者LP(a) 水平均下降。另外,营养不足和炎症状态均可能与血液透析患者LP(a)升高有关。
调脂药物安全性和获益
既不能将CKD 作为他汀治疗的基础疾病,也不能对合并心脑血管疾病的CKD 患者置之不理;将LDL-C 作为评判CKD 人群心血管病风险的单一指标并不可取,而要根据不同CKD 患者脂质代谢特征来综合评估风险,给予最恰当的治疗。